Le potentiel clinique – tout autant que la difficulté éthique – que présentent la technologie d’édition du génome, où l’on « cherche et remplace » des gènes ciblés semble être une discussion sans fin. L’attention du public se focalise, certes, sur la question de savoir si, oui ou non, nous devrions utiliser cette technique pour changer les gènes de l’embryon humain. Mais que l’on soit capable, avec elle, de transplanter chez les humains des tissus et des organes de porcs génétiquement modifiés, voilà une application qui pourrait avoir un effet bien plus grand et bien plus immédiat sur la santé humaine.
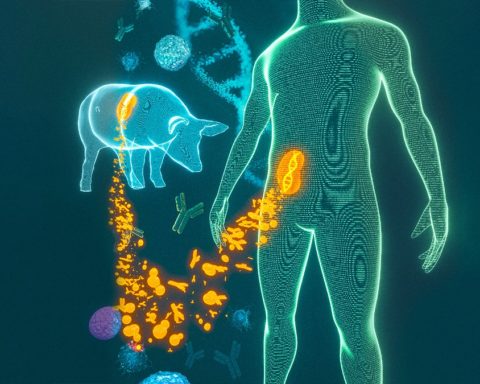
La transplantation de cellules vivantes, de tissus ou d’organes d’une espèce vivante à une autre est connue sous le nom de xénotransplantation. Elle a longtemps été mise en avant comme un moyen de remédier à la pénurie de donneurs d’organes humains. Soit la xénotransplantation prend la forme d’une thérapie définitive, soit elle sert à gagner du temps pour un patient en attente de greffe d’organe humain.
Même si les progrès ont été lents, on a enregistré des effets positifs à la suite d’essais cliniques conduits sur des patients atteints de diabète de type 1 sur qui on a transplanté les cellules pancréatiques d’un porc. Et les travaux sur l’édition du génome publiés en octobre dernier ouvrent des perspectives incroyables pour faire de la xénotransplantation une réalité clinique.
Les défis de la xénotransplantation
La xénotransplantation affronte deux défis majeurs : le risque de rejet et celui de transmission de maladies animales aux personnes (la xénozoonose).
Chez les humains, le rejet de greffe peut être réduit si l’on apparie, avec le plus grand soin, donneur et récipiendaire. Mais c’est d’autant plus difficile dans le cas des humains et des porcs. Le fossé génétique signifie que le système immunitaire de l’homme est programmé pour reconnaître la greffe porcine comme un corps étranger qu’il faut combattre.
En matière de xénozoonose, on craint particulièrement des rétrovirus endogènes. On les trouve dans le génome du porc et on n’arrive pas à les éliminer même avec un élevage biosécurisé. Si ces rétrovirus sont actifs, ils entraînent des pathologies sévères chez les receveurs humains.
Alors que, jusqu’à présent, aucun cas de ce genre d’infections n’a été répertorié chez les gens ayant reçu des greffes porcines, on a pourtant vu ces virus contaminer des cellules humaines cultivées in vitro.
Des scientifiques ont exploré toute une gamme de stratégies : ou bien réduire, ou bien supprimer l’expression de rétrovirus porcins endogènes dans les tissus du cochon pour diminuer le risque de transmission chez l’homme. Mais ces techniques se sont révélées peu efficaces et coûteuses.
 Laboratoire de séquençage de l’ADN
Laboratoire de séquençage de l’ADN L’édition de génomes fondée sur le principe du « trouver et remplacer » (dénommé CRISPR/Cas9) semble, en revanche, offrir de réelles promesses. Des scientifiques de l’université Harvard ont utilisé cette technologie pour cibler et inactiver les rétrovirus endogènes dans le génome des cellules rénales du porc. Cela a réduit par un facteur 1000 la transmission du virus aux cellules humaines in vitro.
Ces chercheurs ont réussi à cibler, à la surface des cellules porcines, les gènes connus pour déclencher une réponse immunitaire du corps humain. Leurs travaux démontrent une possibilité réelle : celle de voir les tissus et organes porcins modifiés génétiquement et transplantés chez les hommes sans avoir besoin de médicament immunosuppresseurs et avec peu de risques de transmission de rétrovirus endogènes porcins.
Défis scientifiques et soucis éthiques
Mais la technologie d’édition du génome par les chercheurs de Harvard n’est pas sans problèmes. Reste un nombre important de défis scientifiques et de préoccupations éthiques.
Au premier rang, s’inscrit l’incertitude liée à la sûreté de cette technologie d’édition du génome CRISPR/Cas9. Les scientifiques se sont aperçus que l’édition ne provoquait pas de mutations indues dans le génome porcin. Mais, au cours de son utilisation dans les embryons humains non viables, il semblerait que la technique se soit traduit par une coupe de segments de l’ADN à des endroits non voulus. Ce qui pourrait provoquer des mutations susceptibles de causer le cancer.
L’un des grands problèmes de la xénotransplantation, c’est que les agents pathogènes s’infiltrant dans un organe peuvent être inconnus. Le risque de xénozoonoses dû à des agents pathogènes non identifiés semble peu élevé, mais les risques potentiels sont conséquents. Et nous devons nous garder de toute arrogance scientifique dans notre exploration enthousiaste des implications de cette technologie pour la xénotransplantation.
Cette technologie soulève aussi des préoccupations de biosécurité et de réglementation. En effet, par rapport aux techniques traditionnelles de modification de gènes, elle s’avère efficace, économique et simple à appliquer. Et comme ce type de biologie s’est démocratisée, les technologies de type CRISPR/Cas9 peuvent être utilisées par des particuliers ou des groupes très éloignés d’une recherche environnementale réglementée. Voire par des gens qui auraient l’intention de synthétiser des organismes virulents pour faire du mal à autrui.
Un renouveau pour la transplantation ?
L’utilisation de CRISPR/Cas9 dans la transplantation peut également augmenter la pression en vue d’étendre son utilisation dans des secteurs d’habitude strictement restreints ou contrôlés. Et la possibilité de s’en servir pour modifier les cellules du sperme, de l’œuf et de l’embryon – c’est-à-dire les cellules germinales –, fait surgir le spectre de l’eugénisme et de l’« augmentation » de l’être humain pour des raisons non médicales. Sans compter que cela ouvrirait la porte à des risques entre générations.
Bien sûr, CRISPR/Cas9 peut donner à la xénotransplantation l’élan qui lui avait fait défaut depuis près de vingt années. Mais uniquement si c’est dans le cadre d’une démarche éthique et sous la surveillance sévère de règles afin de gagner une large adhésion du public.
Ronald Kam Fai Fung, Research Scholar, Centre for Values, Ethics and the Law in Medicine, University of Sydney
Ian Kerridge, Professor of Bioethics & Medicine, Centre for Values and Ethics and the Law in Medicine, University of Sydney
La version originale de cet article a été publiée sur The Conversation.