Le vieillissement ou « Le grand âge », un sujet devenu essentiel en santé publique, représente un risque majeur de cancer et de pathologies chroniques. Or, en 2050, en France comme dans les pays comparables, un habitant sur trois aura 60 ans ou plus. Pour être en mesure de prévenir et/ou de prendre en charge efficacement les maladies liées à l’âge que risquent de développer ces personnes, il est nécessaire de mieux comprendre les mécanismes du vieillissement. Des chercheurs viennent d’identifier des modifications de l’utilisation de l’énergie par les cellules, associés à la sénescence. Ces changements métaboliques pourraient être une cible thérapeutique prometteuse dans les maladies liées au vieillissement.
Phénomène aujourd’hui bien caractérisé, la sénescence est l’état que finit par acquérir une cellule après une accumulation de stress de toutes natures : chaleur, radiations, radicaux libres, manque ou excès de nourriture, drogues, agents polluants… ou encore nombre excessif de divisions. Ce processus physiologique qui entraîne une modification des fonctions de la cellule et un arrêt irréversible de ses divisions, est induite par une exposition aiguë ou chronique de l’organisme à des signaux de stress physiologique (comme par exemple des dommages causés à l’ADN, le vieillissement, l’oncogénèse [1]…).
Lorsqu’elle ne peut ni réparer les dégâts ni se suicider, la cellule change de forme et de fonctionnement. Et l’accumulation de cellules sénescentes dans les tissus semble contribuer à certaines pathologies liées à l’âge. Ce processus physiologique a été associé dans de nombreux travaux aux maladies liées au vieillissement. Néanmoins, les mécanismes biologiques de la sénescence et la manière dont celle-ci pourrait constituer une cible thérapeutique d’intérêt pour lutter contre ces pathologies demeurent encore assez mal compris.
Dans une nouvelle étude publiée dans Nature Metabolism, des scientifiques de l’Inserm, d’université Paris Cité et du CNRS au sein de l’Institut Necker Enfants Malades, ont identifié des changements métaboliques, c’est-à-dire des modifications de l’utilisation de l’énergie par les cellules, associés à la sénescence.
Il est aujourd’hui bien établi que l’accumulation de cellules sénescentes dans l’organisme contribue aux maladies liées à l’âge, mais on ne comprend pas encore entièrement son rôle dans l’initiation de ces pathologies ni tous les mécanismes sous-jacents impliqués.
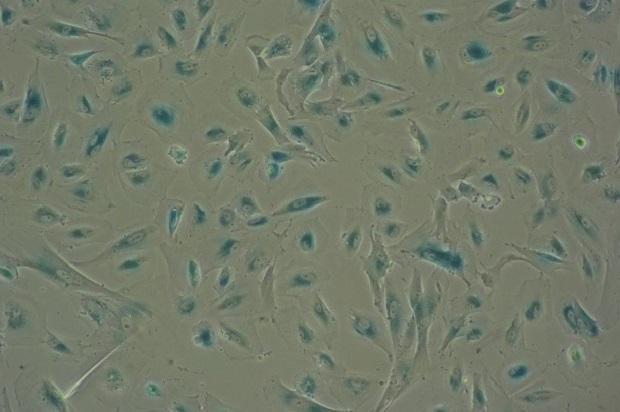
Pour accroitre les connaissances sur le sujet, le chercheur Inserm Mario Pende et ses collègues s’intéressent depuis plusieurs années, notamment dans le cadre du programme scientifique AgeMed, lancé en 2016, aux changements métaboliques qui s’opèrent au niveau des cellules lors du processus de sénescence.
L’équipe dirigée par Mario Pende, membre actif de ce programme de recherche, vise à décrypter les mécanismes cellulaires impliqués dans le processus de vieillissement. Les équipes de Eric Gilson, Oliver Bischof and Bertrand Friguet ont aussi participé à cette étude. L’objectif est d’identifier des voies cellulaires et des cibles moléculaires qui permettront, dans un second temps, de développer des pratiques médicales innovantes pour prévenir et guérir les maladies liées à l’âge.
En effet, la sénescence est caractérisée par une inflammation et une reprogrammation métabolique, c’est-à-dire par une modification de l’utilisation de l’énergie par les cellules. « Comprendre les changements métaboliques qui interviennent au niveau des cellules pendant le vieillissement est donc clé, car cela pourrait ouvrir de nouvelles perspectives pour cibler la sénescence et en retirer des avantages pour la santé » explique Mario Pende.
Dans leur nouvelle étude, les scientifiques ont d’abord eu recours à des approches de transcriptomique (l’analyse de l’ensemble des molécules d’ARN résultant de la transcription du génome) et de métabolomique (l’analyse des métabolites, petits composés organiques issus de l’organisme) pour étudier ces changements in vitro, dans des cellules sénescentes soumises à différents stress.
En combinant ces différentes méthodes, ils ont pu identifier une « signature » métabolique distincte associée à la sénescence. Dans les cellules sénescentes, ils ont en effet constaté qu’il y avait une accumulation de plusieurs métabolites : le lactate, l’alpha ketoglutarate, le glycérol-3-phosphate (G3P) et la phosphoéthanolamine (PEtn). Ces accumulations résultent de modifications dans l’activité de certaines enzymes (dont une enzyme appelée « glycérol kinase »). Ces résultats ont ensuite été confirmés dans d’autres types cellulaires et sur des modèles animaux. « En combinaison avec d’autres mesures, cette signature métabolique pourra être utilisée comme biomarqueur du vieillissement cellulaire et ainsi permettre son suivi pendant la vie d’un individu », souligne Mario Pende.
Dans la seconde partie de l’étude, les scientifiques ont aussi cherché à moduler les changements métaboliques qu’ils avaient observés, afin de voir s’ils pouvaient réduire les effets délétères de la sénescence sur la santé. En utilisant des molécules qui inhibent l’activité de l’enzyme glycérol kinase, ils ont constaté une réduction de l’inflammation liée à la sénescence tout en diminuant l’accumulation de graisses dans les cellules (les triglycérides).
« Nous ne sommes pas parvenus à redémarrer le cycle cellulaire et à pousser les cellules sénescentes à se multiplier à nouveau. En revanche, nous avons pu observer clairement une diminution des marqueurs inflammatoires associés au processus de sénescence. Nos résultats indiquent donc globalement que réguler le changement métabolique observé dans les cellules sénescentes pourrait être une stratégie prometteuse pour cibler la sénescence cellulaire dans les maladies liées au vieillissement », conclut Mario Pende.
Ces travaux ont fait l’objet d’un dépôt de brevet par Inserm Transfert.
Source : Inserm
[1] La conversion d’une cellule normale en cellule cancéreuse